 行业资讯
行业资讯
- 产品
- 企业
- 求购
- 新闻
- 文库
- 工程
- 招采
 行业资讯
行业资讯2020-07-21 来源: 中链企通环保网 浏览量:1381
多种材料对水中氨氮吸附特性
水体黑臭成为危害城市水环境安全的重要隐患.城市水体黑臭主要是由人类向水中排入过量有机污染物, 配合水中微生物和藻类的新陈代谢, 水体缺氧致使厌氧微生物大量繁殖, 产生H2S和NH3等恶臭气体, S2-与水中存在的Fe2+和Mn2+等离子形成黑色物质致使水体发黑.随着各种措施的实施, 水体污染负荷大大降低, 黑臭现象有所好转, 但氨氮难以去除的问题随之凸现出来.
氨氮作为评价水体黑臭的重要指标之一(还包括溶解氧、氧化还原电位和透明度), 是水体中主要的耗氧物质, 也是水体富营养和环境污染的一种重要物质, 进入水体可促使水生动物植物大量繁殖, 造成水体缺氧, 严重影响水质.以游离氨形式存在的氮元素, 会作为有毒物质影响血液与氧的结合, 对鱼类及其他水生生物产生负作用并通过食物链对人类健康造成危害.因此, 氨氮超标是现代城市水体黑臭治理过程中急需解决的问题.
吸附法以其操作方便、工艺简单和稳定性高等特点常被作为去除水中氮磷的有效方法, 污水处理中主要通过与污水中的氮磷之间进行物理吸附、配位体交换或表面沉淀等反应达到去除氮磷的目的.吸附材料通常有孔隙率高, 比表面积大, 吸附活性位点多等特点, 对去除污染物有着至关重要的作用.然而, 污水处理中常用吸附剂(活性炭、活性氧化铝和硅胶等)多为人工合成或经过物理和化学改性等处理, 操作繁琐, 生产、采购价格昂贵, 使用过程中可能会引入某些有毒有害物质, 对自然水体生态造成破坏, 造成二次污染, 因此不适合水体修复工程中大量使用.
本实验首先选取常用的吸附氨氮的材料——沸石和活性炭, 同时经挑选, 选取矿物类吸附剂:麦饭石、硅藻土和膨润土, 此类吸附剂也常用作吸附材料处理水中重金属和有机染料等对环境有害物质, 且来源广泛, 但研究其对氨氮处理效果较少.本文通过多种实验, 模拟黑臭水体氨氮特性, 研究5种材料对氨氮的吸附特性, 旨在挑选出适合黑臭水体治理工程中可大量使用、效果明显、价格低廉的材料.
1 材料与方法
1.1 实验材料及预处理
本实验采用5种不同的材料, 分别为沸石、麦饭石、硅藻土、膨润土和活性炭.沸石和麦饭石采购于石家庄灵寿县某矿石加工厂; 硅藻土、膨润土和活性炭采购于国药集团; 所有材料均通过粉碎机粉碎, 去除杂质, 过100目筛, 取筛下物于烘箱中105℃烘干24 h, 取出后置于干燥器中冷却备用.
所使用的试剂有氢氧化钠、盐酸、酒石酸钾钠、碘化钾、碘化汞和三氯化六氨合钴, 均为分析纯, 氯化铵为优级纯, 国药集团生产; 溶液配制均采用新制备的去离子水; 实验中不同浓度氨氮溶液均由氨氮储备液稀释而得, 储备液配制方法:准确称取3.819 0 g经105℃烘干的优级纯氯化铵, 溶于水中, 移入1 000 mL容量瓶中, 稀释至标线, 得到浓度为1 000 mg·L-1的储备液.
1.2 实验内容
1.2.1 吸附实验
考察5种材料对氨氮的吸附特性(动力学、等温线、投加量和溶液pH).吸附实验步骤为:配制特定浓度的氨氮溶液, 并使用0.1mol·L-1的NaOH和HCl溶液调节pH为特定值, 称取0.2 g吸附材料于50 mL离心管中, 加入40 mL氨氮溶液, 置于25℃恒温振荡箱中以150 r·min-1进行振荡, 一定时间后取出离心, 并测定上清液中氨氮浓度, 采用公式(1)计算材料对氨氮的单位吸附量:

式中, Qe为材料对溶液中氨氮的单位吸附量, mg·g-1; c0和ce分别为初始和吸附平衡时氨氮溶液的浓度, mg·L-1; V为溶液体积, L; m为投加的材料质量, g.
吸附动力学实验:初始浓度为30 mg·L-1, pH为7, 振荡时间为5~480 min.吸附等温线实验:初始浓度为10~250 mg·L-1, pH为7, 振荡时间为120 min.投加量实验:氨氮浓度为30mg·L-1, 氨氮溶液加入量为20 mL, 材料投加量为0.1~0.5 g, pH为7, 振荡时间为120 min, 采用公式(2)计算氨氮去除率. pH影响实验:初始浓度为30mg·L-1, pH分别为4、5、6、7、8、9和10, 振荡时间为120 min.
式中, R为氨氮的去除率, %; c0和ce分别为初始和吸附平衡时氨氮溶液的浓度, mg·L-1; V为吸附溶液的体积, L.
1.2.2 解吸实验
取不同浓度下吸附饱和后的材料, 使用95%的无水乙醇洗涤3次, 置于65℃电热鼓风干燥箱中干燥24 h; 取出干燥后的材料加入40 mL的去离子水, 置于恒温振荡器中振荡一定时间, 转速150r·min-1, 取出后静置稳定24 h, 高速离心, 取适量上清液测定其氨氮浓度并采用公式(3)得出解吸量:
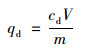
式中, qd为氨氮解吸量, mg·g-1; cd为振荡后氨氮解吸浓度, mg·L-1; V为加入去离子水体积, L; m为材料质量, g.
1.2.3 分析方法
根据国标HJ 537-2009采用纳氏试剂分光光度法测定氨氮浓度.材料表面形貌使用日本日立SU8010冷场发射扫描电镜观察测定.采用六氨合钴离子交换法测定阳离子交换量(cation exchange capacity, CEC):称取适量材料于50 mL离心管中, 加入25 mL六氨合钴离子溶液, 密封, 置于恒温振荡器中, 设定温度为25℃, 以150r·min-1振荡交换1 h.振荡结束, 静置30 min, 离心取上清液于475 nm处测定吸光度并计算上清液中六氨合钴离子浓度, 采用公式(4)计算阳离子交换量:
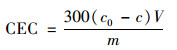
式中, CEC为材料中阳离子交换量, cmol·kg-1; c0为空白实验浓度, mol·L-1; c为振荡交换后溶液浓度, mol·L-1; V为浸提剂体积, mL; m为材料质量, g.
2 结果与讨论
2.1 材料特性表征
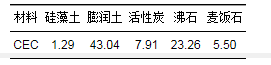
表 1为5种材料的阳离子交换量测定数据.材料中阳离子交换量值越高, 说明材料内部有大量吸附位点, 其饱和吸附量也越大.结果显示, 膨润土阳离子交换量值*大, 为43.04 cmol·kg-1, *小为硅藻土, 1.29 cmol·kg-1.
表 1 5种材料阳离子交换量值/cmol·kg-1
5种材料的扫描电镜结果如图 1所示. 图 1(a)、1(b)为沸石电镜, 可以看出材料表面粗糙, 凹凸不平, 呈鱼鳞状.从图 1(c)看出麦饭石微观呈不规则状(片状、块状等), 表面致密, 截面出现不同程度的褶皱, 未观察到微孔等其他特殊结构.相比之下, 硅藻土的微观结构较规则[图 1(d)], 呈圆盘状, 材料表面布满孔径不一且粗糙的微孔, 这可能是由于其表面存在过多的杂质和有机物. 图 1(e)中, 电镜下的膨润土形如纸团状结构, 边缘不规则并且有着轻微弯曲, 电镜结果与Mo等的研究结果一致.实验所采用的活性炭[图 1(f)]多为不规则块状, 活性炭表面未发现孔状结构, 因此活性炭对氨氮的吸附可能是通过活性炭活化过程中产生的化学基团进行的.
图 1

2.2 吸附特性分析
2.2.1 吸附动力学
5种材料的动力学研究中分别采用3种动力学方程进行拟合, 拟合曲线见图 2, 拟合参数见表 2.通过3种不同吸附动力学方程拟合氨氮吸附过程, 可以识别材料的吸附机制.本文采用准一级动力学方程、准二级动力学方程以及颗粒内扩散方程对实验数据进行拟合.
图 2
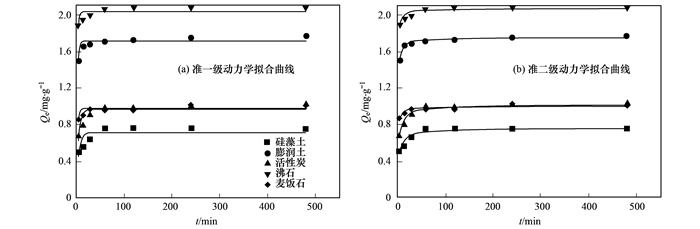
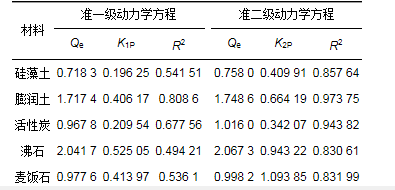
表 2 5种材料对氨氮吸附的动力学拟合参数
![]()
准二级动力学方程(Pseudo-second-order)表示为:
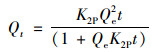
颗粒内扩散方程(Intrapartide diffusion model)表示为:
式中, Qt为t时刻的吸附量, mg·g-1; t为吸附时间, min; Qe为平衡时刻的吸附量, mg·g-1; K1P为准一级动力学方程的吸附速率常数, min-1; K2P为准二级动力学方程的吸附速率常数, g·(mg·min)-1; K3P为颗粒内扩散速率常数, mg·(g·min0.5)-1; c为经验常数, 与边界层厚度相关, c值越大边界层效应越大.
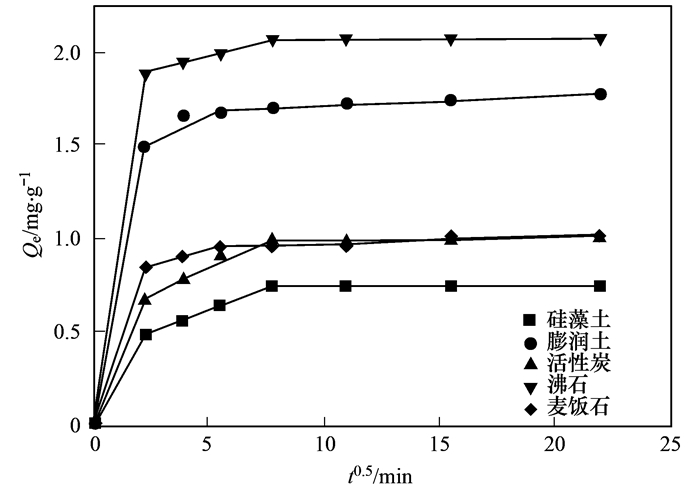
从图 2中可得出, 5种吸附材料对水中氨氮的吸附分为快速吸附过程和吸附平衡过程.快速吸附过程, 0~120 min, 选取的材料吸附量随时间增加而增加, 快速吸附主要由于材料本身有着大量的吸附空闲位点, 随着吸附过程的进行, 空闲吸附位点迅速被NH4+占据, 形成快速吸附阶段; 120 min过后, 5种材料吸附量不再随时间增加而增加, 在一定范围内波动, 即判定为吸附平衡阶段.平衡阶段的出现是由于材料层间可交换的阳离子全部被水中的NH4+交换, 吸附位点全部被占据.通过研究材料吸附污染物的动力学, 可以将其吸附过程控制在较短时间, 提高效率、降低能耗.对比5种材料的平衡吸附量, 沸石平衡吸附量*大, 达到2.07mg·L-1, 其次为膨润土, 麦饭石, 活性炭和硅藻土, 平衡吸附量分别为1.77、1.03、1.02和0.75 mg·L-1.
5种材料拟合得到的参数见表 2.从中可知, 准一级动力学方程对5种材料拟合得到的R2均在0.81以下, 且整体低于准二级动力学方程拟合得到的R2值.同时, 准二级动力学拟合方程计算得到的平衡吸附量更加接近实验得到的*大吸附量, 分别为2.067 3、0.998 2、0.758 0、1.748 6和1.016 0 mg·L-1.因此, 准二级动力学拟合方程更加准确地描述了实验材料吸附的全过程, 可以判断5种材料对氨氮的吸附以化学吸附为主.
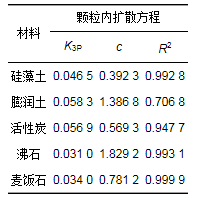
为了更好地了解材料的扩散机制, 采用颗粒内扩散模型来分析其机制.根据颗粒内扩散模型理论, 若Qt与t0.5曲线为通过原点的直线, 则颗粒内扩散为吸附速率唯一限制因素; 若Qt与t0.5曲线为不通过原点的直线, 则颗粒内扩散为吸附速率的限制因素.如图 3所示, 5种材料对氨氮吸附分为3个阶段.第一阶段为表面的快速吸附, 由于NH4+迅速穿过边界层扩散至材料表面, 迅速在表面聚集, 并与材料表面结合形成了一条过原点的直线; 第二阶段进入吸附速率放缓的扩散阶段, 氨氮分子向材料内部孔隙进行扩散吸附, 导致图中第二阶段斜率下降, 吸附速率放缓; 第三阶段则为吸附平衡期, 主要原因是材料内外部吸附位点全部被分子占据.由于第一、三阶段为表面聚集和平衡阶段, 因此表 3列出的为第二阶段缓慢吸附拟合后的参数.公式(7)中c表示方程的截距, 通过计算, 5种材料的c值全部为非零值, 表明缓慢吸附阶段, 颗粒内扩散不是影响材料吸附氨氮的唯一因素.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
图 3
2.2.2 吸附等温线
吸附等温线是描述体系中吸附剂表面和溶液中吸附质数量关系的曲线.本实验通过Langmuir和Freundlich等温方程对不同材料的吸附数据进行拟合并研究. Langmuir公式为理论公式, 根据吸附的物质只有一层分子厚的假定推导出来的, 由于吸附剂表面积是一定的, 公式中必然会出现吸附量的极限值. Freundlich公式则属于经验公式, 用来描述多层分子吸附的过程.对于吸附的实验数据, 通过作图来求出对应常数以确定更加符合何种等温模型.两种模型分别表述如下.
Langmuir等温吸附公式可表述为:
Freundlich等温吸附模型可以表述为:
式中, Qe为单位质量吸附量, mg·g-1; ce为平衡溶液中氨氮的浓度, mg·L-1; Qm为*大吸附量, mg·g-1; KL和KF表示吸附表面强度的常数, L·mg-1; n为吸附强度指标.
此外, 通过分离因子RL可以判断所用吸附材料是否有效吸附水中污染物[19]:
式中, c0为溶液中氨氮初始浓度, mg·L-1; RL值受吸附质起始值浓度影响, 当0 < RL < 1, 判断为有利吸附(优惠吸附); RL>1为不利吸附(非优惠吸附); RL=1为线性吸附; RL=0为不可逆吸附.
Langmuir和Freundlich拟合曲线见图 4.从中可知, 随着溶液中氨氮初始浓度的增加, 材料的平衡吸附量也随之增高, 高浓度下, 吸附量增加较缓慢, 这是由于单位吸附材料随着初始浓度的增高能够与更多的NH4+接触.随后, NH4+在有效吸附位点趋于饱和, 吸附速率放缓. 表 4为2种等温吸附模型对不同材料的拟合后得出的参数.从中可知, 硅藻土Langmuir方程拟合相关系数R2大于Freundlich方程拟合相关系数, 因此硅藻土对氨氮的吸附类型为单层吸附.此外, Langmuir模型中KL的值代表材料表面的吸附结合能, 5种材料的KL值由大到小为沸石, 麦饭石, 硅藻土, 膨润土和活性炭, 拟合结果与实验所得结果不一致.而其他4种材料则符合Freundlich等温方程, 属于多层分子吸附.对比其它拟合相关系数R2, 其它4种材料则更加符合Frendlich等温方程, 为多层分子吸附. Freundlich模型中KF越大, 吸附容量越大.沸石KF值*大, 对溶液中氨氮的吸附量也*大, 其他4种材料依次为麦饭石, 膨润土, 活性炭和硅藻土, 所得结果与实验一致, 因此Freundlich更好地描述了材料对氨氮的吸附.
图 4
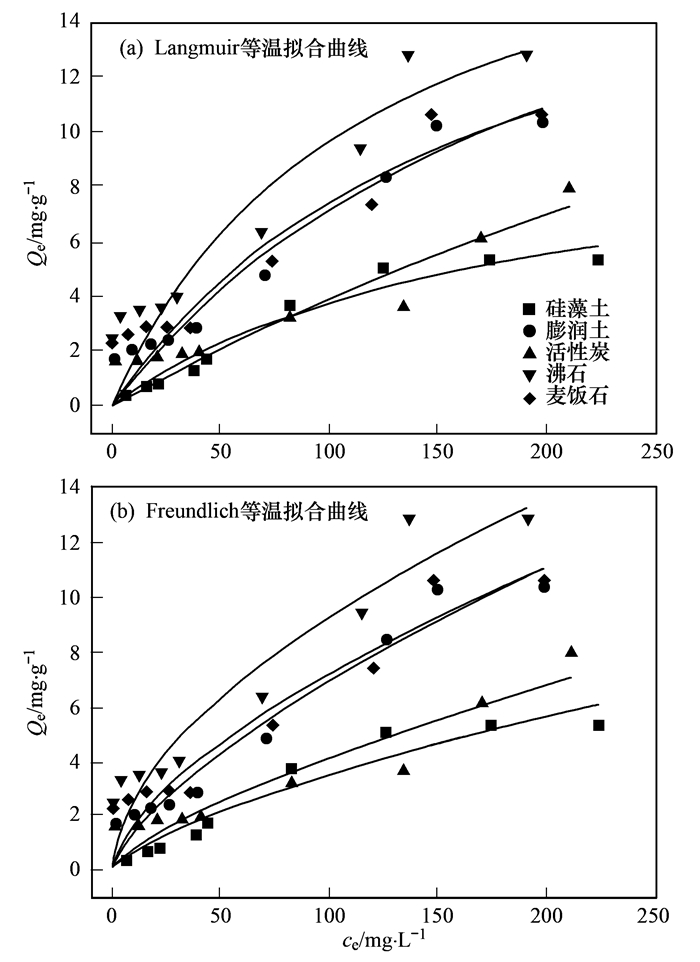
表 4 5种材料对氨氮吸附等温方程拟合参数
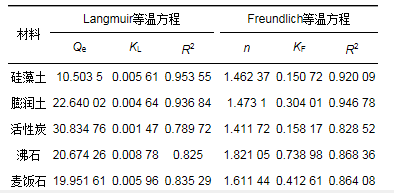
由图 5可知, 5种材料的RL随氨氮初始浓度增加而减小, 值均在0~1之间, 表明吸附为有利吸附.同时, 模型中n作为吸附强度指标, n < 1属于差吸附, 1 < n < 2为难度适中的吸附, 2 < n < 10属于良好吸附.由表 4可知, 5种材料中的n值在1~2之间, 为难度适中的吸附.
图 5
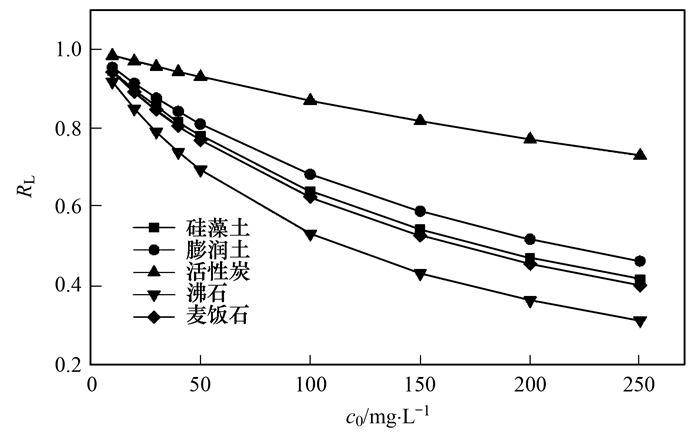
动力学和等温线测定结果与阳离子交换量数据有所不同, 而阳离子交换量通常是由层间可交换性阳离子及断面破键水解吸附阳离子共同贡献的.通常情况下, 沸石, 膨润土等矿石材料骨架由不同形式的硅酸盐或硅氧结构组成, 其中的硅被铝或其他金属代替, 使得其微观结构带有负电荷, 与Na+等阳离子结合, 聚集在材料内部. 5种材料中膨润土的CEC值高于沸石, 但其吸附量却低于沸石.从图 1可知, 膨润土外观边缘不规则并且有着轻微弯曲, 致使表面附着更多的阳离子, 而这些阳离子并未在平衡骨架电性中起到作用, 在振荡实验中也与六氨合钴离子发生交换.同时也可推测出膨润土对氨氮有效吸附位点位于层间隙和微孔中.活性炭通常对污染物吸附通过范德华力或者化学键, 表面通过范德华力结合部分的阳离子会与六氨合钴离子发生交换, 但对氨氮的去除并未起到太大作用.硅藻土表面层由杂质和有机物构成, 使得表面微孔孔径不一, 少量的阳离子存在于表面的微孔中, 减弱对氨氮吸附的能力.
2.2.3 不同投加量对氨氮的去除效果
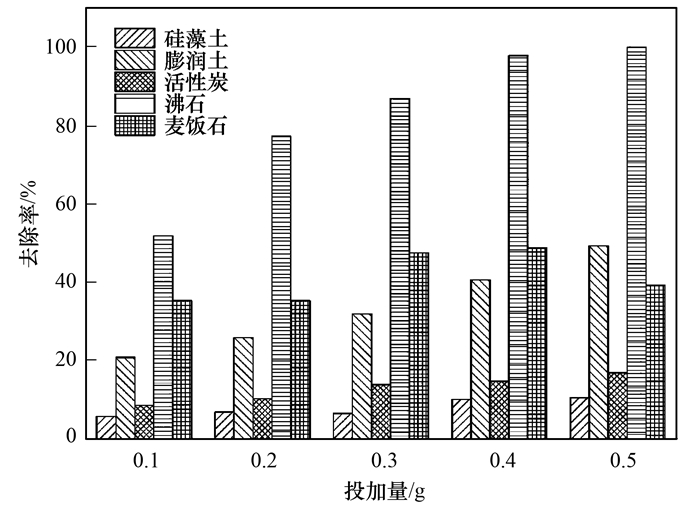
图 6为5种材料不同投加量对氨氮吸附的影响.从中可知, 随着投加量的增加, 硅藻土、膨润土、活性炭和沸石对水中氨氮的吸附效果随着增加, 投加量为0.5g时, 氨氮去除率*大, 4种材料对吸附水中氨氮去除率分别为10.46%、49.25%、16.87%和100%.当麦饭石投加量为0.4g时, 去除率*高为48.85%, 然而投加量为0.5g时, 对氨氮去除率下降至39.2%.这个现象出现可能是在材料投加量少时, NH4+会大量聚集在材料颗粒与颗粒之间, 这样, 吸附向有利方向进行, 即NH4+被材料吸附; 随着材料的投加量增加, 颗粒之间的距离减小, 使得NH4+存在空间减小, 不利于NH4+与吸附位点结合, 导致吸附量减小.
图 6
2.2.4 不同初始pH对氨氮去除影响
考察pH对氨氮吸附的影响, 结果如图 7.溶液pH是影响吸附效果的重要条件, H+或者OH-在溶液中可能会改变吸附剂表面电荷. 5种材料在碱性条件下均得到*高的吸附量.沸石和麦饭石随着pH升高, 其吸附量先增加后减少, 在pH=8时得到*大吸附量, 为4.27mg·g-1和3.42mg·g-1.硅藻土、膨润土和活性炭在整个pH范围内缓慢增长, 在pH=10时取得*大值分为别1.26、1.85和1.49 mg·g-1.在酸性条件下, 材料表面被H+质子化, NH4+与材料表面发生排斥, 降低了材料对NH4+的结合力; 随着pH升高, 质子化作用减弱, 吸附量也随之升高并至*大值; 同时NH4+在水中与NH3·H2O发生公式(11)和(12)的转化, NH4+含量逐渐减少, 与内部阳离子交换能力被削弱, 吸附量减小.因此pH值很大程度上会影响对氨氮的吸附.
图 7

2.3 解吸特性分析
吸附材料对氨氮吸附饱和后在水中的解吸性能是选择材料的重要依据, 通过解吸能力可以判断材料的稳定性.对于5种材料的解吸实验, 从图 8和图 9中看出解吸量全部随初始浓度的升高而升高.初始浓度的增高, 溶液和材料表面及内部形成浓度差, 所形成的浓度差为NH4+扩散提供动力, 首先快速聚集至材料表面, 然后向材料内部迁移, 浓度越大导致NH4+能量越大, 向内部迁移速率也就越大, 导致材料吸附量增大的同时, 吸附饱和后也使NH4+在材料表面形成聚集, 不能向内部迁移.解吸条件下, 在表面积累或处于迁移状态下的NH4+随初始浓度增加而增加, 因此5种材料解吸的NH4+量随初始浓度增加而增加.
图 8

图 9
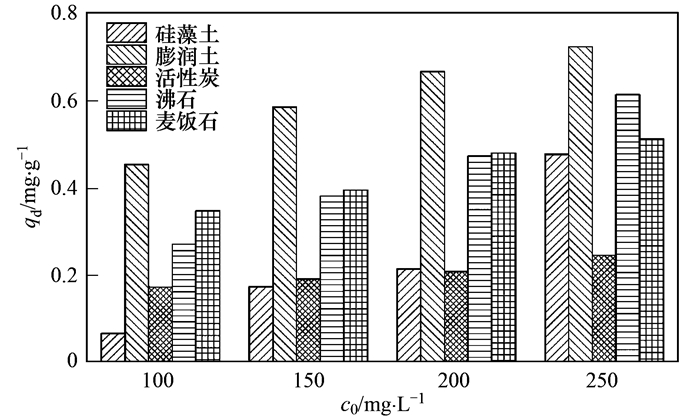
结合阳离子交换量和表面微观结构分析, 膨润土微观结构表面及边缘不规则容易在表面附着不能进行有效交换的阳离子, 表面未有效结合的NH4+在振荡过程中脱离材料表面重新进入水体, 导致膨润土解吸量*大, 造成二次污染.沸石、麦饭石表面褶皱等结构使其具有较大比表面积, 表面会附着聚集NH4+, 随着初始浓度升高, 附着在表面的NH4+较多, 解吸量较大, 但低于膨润土, 由于二者吸附量较大, 解吸量所占比例较小; 相比于硅藻土和活性炭, 表面结构单一, CEC值小, 致使其吸附量、解吸量都很低.
3 结论
(1) 通过对材料吸附数据的拟合, 5种材料对氨氮的吸附均符合准二级动力学方程, 以化学吸附为主; 颗粒内扩散影响其吸附过程, 但非唯一控制因素; 通过对等温吸附数据拟合, 硅藻土更适合Langmuir等温方程, 为单层分子吸附, 而其他4种材料更加符合Freundlich等温方程, 则为多层分子吸附.
(2) 氨氮去除率随投加量增加而提高. 5种材料对于低浓度氨氮去除有良好效果, 均适合轻度黑臭水体氨氮的去除; 沸石更加适合用于重度黑臭水体中氨氮的去除.
(3) 不同pH条件下, 沸石和麦饭石对氨氮的吸附量先增加后减少, 在pH=8时取得*大吸附量; 其他3种材料在实验pH值范围内吸附量缓慢升高.
(4) 5种材料相对比, 膨润土解吸能力较强, 不适合长时间吸附水中氨氮; 硅藻土和活性炭吸附量小, 解吸能力弱, 可在水体中长时间吸附氨氮; 沸石和麦饭石吸附量大, 解吸能力适中, 工程中材料选取可视实际情况选择.
 微信公众号
微信公众号
 在手机端查看
在手机端查看
版权与免责声明:
凡注明稿件来源的内容均为转载稿或由企业用户注册发布,本网转载出于传递更多信息的目的;如转载稿涉及版权问题,请作者联系我们,同时对于用户评论等信息,本网并不意味着赞同其观点或证实其内容的真实性;
本文地址:neibu.hbchanyelian.com/News-16761
转载本站原创文章请注明来源:中链企通环保网